脆性X染色体综合征 (Fragile X syndrome, FXS) 是最常见的遗传性智力障碍,该病患者在生命早期可表现出一系列沟通技巧、认知能力、外貌上的缺陷,以及癫痫、焦虑等症状。FXS是由FMR1基因的5’UTR中CGG短串联重复序列 (short tandem repeat, STR) 扩增引起的,序列长度与疾病严重程度相关,可划分为<40(正常长度[NL])、41-60(过渡长度)、61–199(前突变)和200+(突变长度[ML])重复,其中,具有前突变长度 (premutation, PM) CGG序列的FMR1的个体有患晚期神经退行性疾病脆性X相关震颤/共济失调综合征 (FXTAS) 的风险【1】。这些数据强调了CGG STR长度在疾病表现中的关键作用。
有趣的是,在FXTAS中,从NL到PM的CGG扩增导致FMR1表达增加2至8倍,相反,扩增至ML却导致FMR1的转录抑制和其编码的脆性X信使核糖核蛋白(FMRP)的丢失。研究表明,FMR1的转录沉默是通过MLFMR1 CGG域及其相邻启动子的局部DNA甲基化和异染色质化而发生的【2-4】。然而,人们发现通过5-aza-2’-deoxycytidine药物阻断DNA甲基化或通过dCas9-Tet1靶向DNA去甲基化并不能完全恢复FMR1的表达【5】。这些证据表明FXS的发生和进展可能涉及局部启动子DNA甲基化之外的其他沉默机制。
近日,来自宾夕法尼亚大学的Jennifer E. Phillips-Cremins团队在Cell杂志上发表了文章 Spatially coordinated heterochromatinization of long synaptic genes in fragile X syndrome ,他们使用Nanopore长读长测序、千碱基分辨率Hi-C、CUT&RUN、CRISPR和单细胞Oligopaint FISH成像等技术证明常染色体和X染色体上Mb级的H3K9me3域更易出现在ML CGG扩增型FXS患者的脑组织中,将ML CGG STR编辑为PM可逆转H3K9me3、解除反式相互作用并恢复基因表达。此外,他们还发现具有NL CGG STR的iPSCs也可由于其他非FXS途径引起的遗传不稳定性而表现出BREACH(beacons of repeat expansion anchored by contacting heterochromatin)。总之,这项工作揭示了易受不稳定影响的基因座之间的Mb级异染色质化和反式相互作用。

与之前的发现一致,该团队发现3个独立FXS患者衍生的iPSCs具有相似的420-470个(中位数)CGG STR、FMR1启动子和CGG处的DNA甲基化,以及严重的基因组错误折叠,H3K9me3除了位于FMR1外,还向上游扩散至高达5 Mb区域,其中就包含与神经元细胞粘附和突触可塑性相关基因。出乎意料的是,该团队在此发现Mb级的H3K9me3域除了存在于X染色体上,还存在于常染色体上,且该区域同时包含在突触可塑性中有明确作用的CSMD1和DPP6等基因。这些观察结果并非是iPSCs诱导所致,在患者尸检脑组织中也能观察到类似的常染色体H3K9me3域。如果利用CRISPR将ML CGG STR削减为PM则能完全逆转X染色体H3K9me3域、恢复FMR1基因表达,并更正FXS iPSC中X染色体的错误折叠,说明ML CGG对于异染色质域上H3K9me3信号的维持是必要的。
Hi-C结果显示ML CGG扩增的iPSCs中存在强烈的染色体间相互作用,将FMR1位点连接到常染色体H3K9me3域,但在ML CGG编辑为PM后,FMR1基因座和失去H3K9me3信号的常染色体域也在空间上与其他基因座断开。为了验证反式相互作用,他们使用Oligopaint DNA FISH探针对单细胞中的H3K9me3域成像,观察到chrX和chr12上的H3K9me3域在ML比例较高的情况下联系更加紧密,将ML编辑为PM后可恢复chrX和chr12域之间的空间距离,这些发现表明在FXS中,常染色体H3K9me3域与FMR1 H3K9me3域形成CGG长度依赖的反式相互作用。
为了阐明与FXS基因组不稳定性相关的可能信号通路,该团队对NL、PM和ML FXS iPSCs中进行RNA-seq分析,发现与DNA损伤反应和p53介导的细胞周期停滞途径在ML FXS iPSCs中失调。已知敲除p53会增加基因组不稳定性并导致癌症中H3K9me3累积,他们用p53 shRNA处理NL iPSCs,观察到在FXS中几个常染色体位置和X染色体位置上也出现了H3K9me3信号,说明这是一种不局限于FXS的普遍现象,可能与FXS之外的基因组不稳定的多种途径相关。
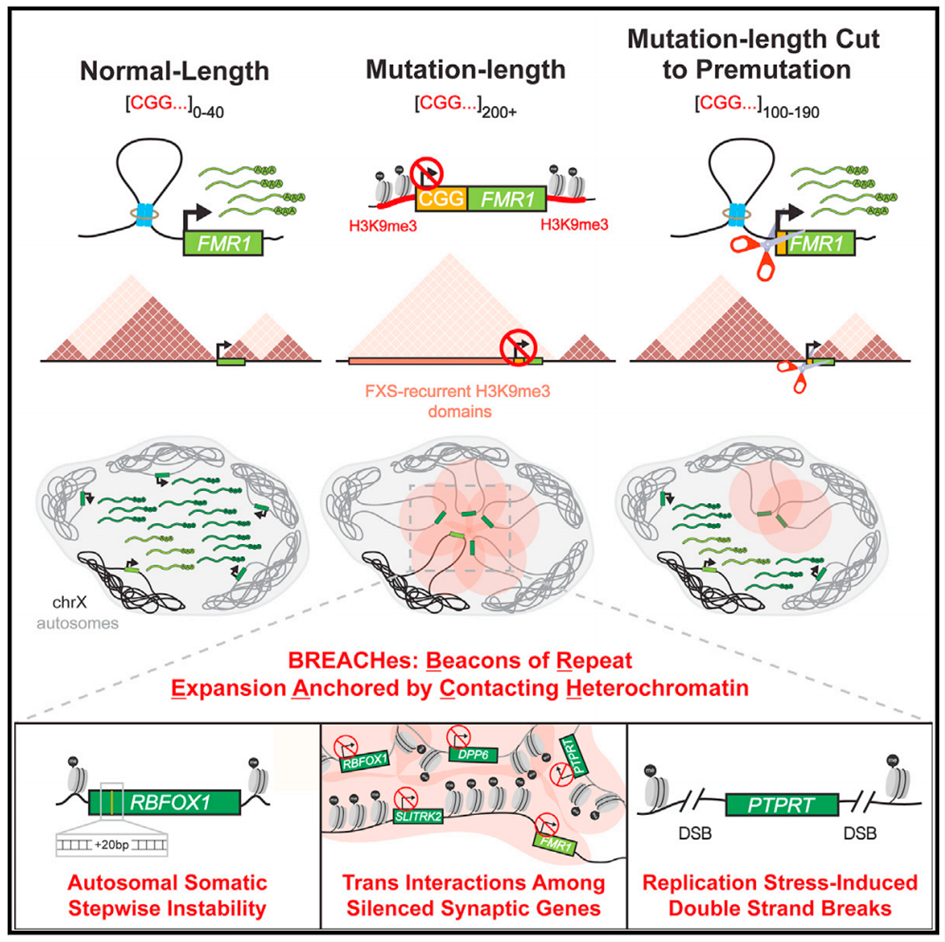
FXS经典模型认为它是一种由CGG STR扩增导致FMR1启动子局部DNA甲基化,进而导致FMR1转录沉默和FMRP丢失的单基因疾病,且这种STR仅出现在X染色体上,而这项工作基于FXS患者死后脑组织或细胞系研究数据出乎意料地发现在常染色体上也存在STR,并提出了空间协调转录沉默模型,为探索远程异染色质介导的沉默与FXS中其他已知分子表型之间的机制相互作用开辟了未来的研究方向。
原文链接:https://doi.org/10.1016/j.cell.2023.11.019
参考文献
1. Hagerman, R.J., and Hagerman, P. (2016). Fragile X-associated tremor/ataxia syndrome - features, mechanisms and management. Nat. Rev. Neurol. 12, 403–412.
2. Orr, H.T., and Zoghbi, H.Y. (2007). Trinucleotide repeat disorders. Annu. Rev. Neurosci. 30, 575–621.
3. Sutcliffe, J.S., Nelson, D.L., Zhang, F., Pieretti, M., Caskey, C.T., Saxe, D., and Warren, S.T. (1992). DNA methylation represses FMR-1 transcription in fragile X syndrome. Hum. Mol. Genet. 1, 397–400.
4. Colak, D., Zaninovic, N., Cohen, M.S., Rosenwaks, Z., Yang, W.Y., Gerhardt, J., Disney, M.D., and Jaffrey, S.R. (2014). Promoter-bound trinucleotide repeat mRNA drives epigenetic silencing in fragile X syndrome. Science 343, 1002–1005.
5. Coffee, B., Zhang, F., Warren, S.T., and Reines, D. (1999). Acetylated histones are associated with FMR1 in normal but not fragile X-syndrome cells. Nat. Genet. 22, 98–101.













